基礎医学系講座
組織学・細胞生物学Department of Histology and Cell Biology
- TEL
- 059-232-1111(内6323)
- FAX
- 059-231-5263
- URL


造血器、表皮、腸管粘膜などを代表に、全身の多くの組織では、絶えず、新たな細胞を供給することで組織の構築や機能を維持しています。言い換えると、これらの組織を維持していくためには、細胞増殖過程が厳密に制御される必要があります。細胞が増殖するためには、S期に自身の染色体(DNA)を正確に複製し、それを分裂(M)期に2つの娘細胞に均等に分配する必要があります。通常、S期とM期の前には、(それを準備するための)G1期、G2期と呼ばれる時期があり、G1→S→G2→Mという一連の過程(細胞周期)を経て、細胞は増殖します。この細胞周期の制御機構が破綻し、無秩序に増殖するようになると細胞はがん化し、逆に、増殖が強く抑制されるようになると細胞は老化します。我々は、これまで、がん化や老化の分子機構を細胞周期の制御異常の観点から探究してきました。
- 教 授
- 後藤 英仁
- 講 師
- 稲葉 弘哲
- 助 教
(学内講師) - 大森 拓
- 学部担当科目
- 組織学(総論・各論)、神経解剖学(脳実習含む)、分子生命体科学(一部、分担)
- 附属病院診療科
- -
- 居室
- 先端医科学教育研究棟 4階
研究・教育内容
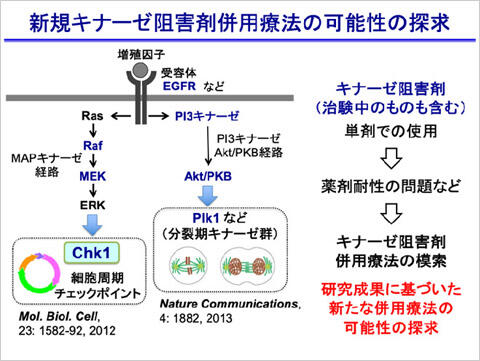
細胞が増殖していく過程、つまり、細胞周期の進行には、細胞周期特異的に活性化されるタンパク質リン酸化酵素(キナーゼ)が中心的な役割を担っています。サイクリンとそれによって活性化されるCDK(サイクリン依存性キナーゼ)がその代表ですが、これ以外にもAurora-A、Aurora-B、Plk1などの分裂期キナーゼ群やChk1などのチェックポイントキナーゼ群が重要な役割を担っています。興味深いことに、様々ながんでAurora-A、Aurora-B、Plk1、Chk1が異常に活性化していることが知られており、抗がん治療の標的タンパク質としてもこれらのキナーゼはとても注目されています。我々は、これまでの研究で、これらキナーゼの解析を中心におこない、これらキナーゼ阻害剤がどのようにがん細胞の増殖を抑え、細胞死や細胞老化へと導くのかについて明らかにしてきました。また、これらキナーゼ間の相互作用を明らかにすることで、キナーゼ阻害剤をどのように組み合わせると抗がん治療に役立つ可能性が高いかについても端緒となる知見を得てきました。さらに、研究を進めていくことで新たな抗がん治療を提言できるようにしていきたいと考えています。
研究業績
-
Chk1-mediated Cdc25A degradation as a critical mechanism for normal cell cycle progression.
Goto H, Natsume T, Kanemaki MT, Kaito A, Wang S, Gabazza EC, Inagaki M, Mizoguchi A.
J Cell Sci. 2019 Jan 25;132(2):jcs223123. doi: 10.1242/jcs.223123. -
Ndel1 suppresses ciliogenesis in proliferating cells by regulating the trichoplein-Aurora A pathway.
Inaba H, Goto H, Kasahara K, Kumamoto K, Yonemura S, Inoko A, Yamano S, Wanibuchi H, He D, Goshima N, Kiyono T, Hirotsune S, Inagaki M.
J Cell Biol. 2016 Feb 15;212(4):409-23. doi: 10.1083/jcb.201507046. -
Cytokinetic Failure-induced Tetraploidy Develops into Aneuploidy, Triggering Skin Aging in Phosphovimentin-deficient Mice.
Tanaka H, Goto H, Inoko A, Makihara H, Enomoto A, Horimoto K, Matsuyama M, Kurita K, Izawa I, Inagaki M.
J Biol Chem. 2015 May 22;290(21):12984-98. doi: 10.1074/jbc.M114.633891. -
PI 3-kinase-dependent phosphorylation of Plk1-Ser99 promotes association with 14-3-3γ and is required for metaphase-anaphase transition.
Kasahara K, Goto H, Izawa I, Kiyono T, Watanabe N, Elowe S, Nigg EA, Inagaki M.
Nat Commun. 2013;4:1882. doi: 10.1038/ncomms2879. -
P90 RSK arranges Chk1 in the nucleus for monitoring of genomic integrity during cell proliferation.
Li P, Goto H, Kasahara K, Matsuyama M, Wang Z, Yatabe Y, Kiyono T, Inagaki M.
Mol Biol Cell. 2012 Apr;23(8):1582-92. doi: 10.1091/mbc.E11-10-0883. -
Nuclear Chk1 prevents premature mitotic entry.
Matsuyama M, Goto H, Kasahara K, Kawakami Y, Nakanishi M, Kiyono T, Goshima N, Inagaki M.
J Cell Sci. 2011 Jul 1;124(Pt 13):2113-9. doi: 10.1242/jcs.086488. -
14-3-3gamma mediates Cdc25A proteolysis to block premature mitotic entry after DNA damage.
Kasahara K, Goto H, Enomoto M, Tomono Y, Kiyono T, Inagaki M.
EMBO J. 2010 Aug 18;29(16):2802-12. doi: 10.1038/emboj.2010.157. -
Novel positive feedback loop between Cdk1 and Chk1 in the nucleus during G2/M transition.
Enomoto M, Goto H, Tomono Y, Kasahara K, Tsujimura K, Kiyono T, Inagaki M.
J Biol Chem. 2009 Dec 4;284(49):34223-30. doi: 10.1074/jbc.C109.051540. -
Complex formation of Plk1 and INCENP required for metaphase-anaphase transition.
Goto H, Kiyono T, Tomono Y, Kawajiri A, Urano T, Furukawa K, Nigg EA, Inagaki M. Nat Cell Biol. 2006 Feb;8(2):180-7. doi: 10.1038/ncb1350. -
Phosphorylation by Cdk1 induces Plk1-mediated vimentin phosphorylation during mitosis.
Yamaguchi T, Goto H, Yokoyama T, Silljé H, Hanisch A, Uldschmid A, Takai Y, Oguri T, Nigg EA, Inagaki M.
J Cell Biol. 2005 Nov 7;171(3):431-6. doi: 10.1083/jcb.200504091.