基礎医学系講座
分子病態学Department of Molecular Pathobiology
- TEL
- 059-231-5036
- FAX
- 059-231-5209


分子病態学では、細胞間・臓器間コミュニケーションを制御する分子メカニズムを細胞接着分子インテグリンに注目し研究しています。白血球や白血病細胞は接着分子インテグリンを使い、血管内皮に接着し、臓器に深く浸潤します。私たちは細胞接着能と浸潤能の基盤となるインテグリン親和性制御の機序や細胞間のコミュニケーションを担う接着分子コネキシンの血管内皮における新規機能を解明してきました。接着分子インテグリンは標的臓器へのリンパ球ホーミング、さらには標的臓器内でのリンパ球活性化という免疫病の病態生理において重要な2つのステージで、細胞接着を制御しています。インテグリンの親和性は正常細胞では低く維持されるが、免疫病や癌では異常に亢進します。私たちは新規インテグリン・ノックインマウスより得られた知見から、インテグリン親和性バランス制御の"乱れ"が病態生理に与えるインパクトの分子基盤を研究しています。
- 教 授
- 島岡 要
- 准教授
- 朴 恩正
- 学部担当科目
- 分子病態学、分子医学実習
- 附属病院診療科
- -
- 居室
- 総合研究棟Ⅰ 4階
研究・教育内容
接着分子インテグリンによるダイナミックな細胞接着は、免疫細胞の臓器特異的ホーミングや、白血病細胞が臓器に浸潤するプロセスを制御しています。インテグリンの接着性バランスを制御する機序を、血管内皮細胞の統合性維持に不可欠なコネキシンとのクロストークなどを中心に、血管生物学的システムの恒常性が維持されるメカニズムを研究します。生体内で細胞の接着と移動を制御し、細胞間でのコミュニケーションを司る接着分子システムの機能を深く理解することにより、免疫病や癌転移における細胞動態を明らかにし、臨床現場にその知見を還元するをモットーに研究をしています。
細胞外小胞は細胞から放出される脂質2重膜からなる生体ナノ粒子であり、細胞外小胞の中でもサイズが〜100nmのエキソソームは、エンドゾーム経路によりつくられ細胞外に分泌され、細胞間コミュニケーションを担っています。インテグリンは細胞表面に発現するのと同様に、エキソソーム表面にも発現し、生体内での臓器分布決定に重要な役割を果たしています。リンパ球の分泌するエキソソームは、先回りしてホーミングニッチにある血管内皮細胞に到達し、インテグリン・リガンドやケモカインの発現を変化させることにより、免疫細胞の生体内でのトラフィッキングパターンや臓器間ネットワークの制御に関わっています。このようなエキソソーム・インテグリンによるホーミングニッチのリモデリングの重要性に関わる研究をしています。
細胞間のコミュニケーションをよりマクロでメタな視点まで、ズームアウトして捉える研究も行っています。人と人とのコミュニケーションを客観的かつ網羅的に把握し、定量的に解析するために、ウェアラブルセンサーを用いて、医療関係者の多職種連携のパターンや睡眠のパターンが、病院環境因子や患者因子がどのように関係し、病院エコシステムを構築しているのかに関わるヒューマン・ビヘイビアーも研究しています。


研究業績
-
Endothelial connexin-integrin crosstalk in vascular inflammation.
Okamoto T, Park EJ, Kawamoto E, Usuda H, Wada K, Taguchi A, Shimaoka M. Biochim Biophys Acta Mol Basis Dis. 2021 May 13;1867(9):166168. doi: 10.1016/j.bbadis.2021.166168. Online ahead of print. -
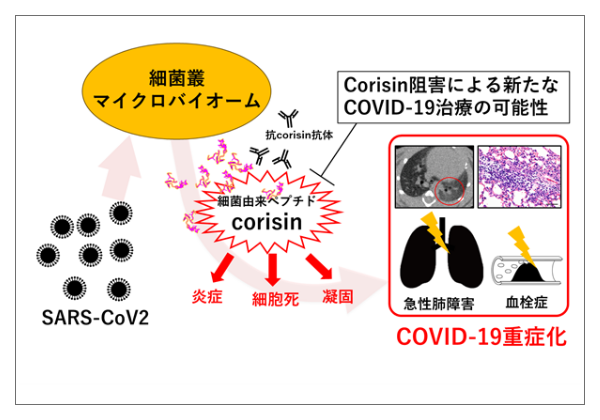
The Spike Glycoprotein of SARS-CoV-2 Binds to β1 Integrins Expressed on the Surface of Lung Epithelial Cells.
Park EJ, Myint PK, Appiah MG, Darkwah S, Caidengbate S, Ito A, Matsuo E, Kawamoto E, Gaowa A, Shimaoka M. Viruses. 2021 Apr 9;13(4):645. doi: 10.3390/v13040645. -
Irisin supports integrin-mediated cell adhesion of lymphocytes.
Myint PK, Ito A, Appiah MG, Obeng G, Darkwah S, Kawamoto E, Gaowa A, Park EJ, Shimaoka M. Biochem Biophys Rep. 2021 Mar 8;26:100977. doi: 10.1016/j.bbrep.2021.100977. eCollection 2021 Jul. -
Integrin-Ligand Interactions in Inflammation, Cancer, and Metabolic Disease: Insights Into the Multifaceted Roles of an Emerging Ligand Irisin.
Park EJ, Myint PK, Ito A, Appiah MG, Darkwah S, Kawamoto E, Shimaoka M. Front Cell Dev Biol. 2020 Oct 26;8:588066. doi: 10.3389/fcell.2020.588066. eCollection 2020. -
Intestinal Epithelium-Derived Luminally Released Extracellular Vesicles in Sepsis Exhibit the Ability to Suppress TNF-a and IL-17A Expression in Mucosal Inflammation.
Appiah MG, Park EJ, Darkwah S, Kawamoto E, Akama Y, Gaowa A, Kalsan M, Ahmad S, Shimaoka M. Int J Mol Sci. 2020 Nov 10;21(22):8445. doi: 10.3390/ijms21228445. -
Sepsis Induces Deregulation of IL-13 Production and PD-1 Expression in Lung Group 2 Innate Lymphoid Cells.
Akama Y, Park EJ, Satoh-Takayama N, Gaowa A, Ito A, Kawamoto E, Darkwah S, Appiah MG, Myint PK, Ohno H, Imai H, Shimaoka M. Shock. 2021 Mar 1;55(3):357-370. doi: 10.1097/SHK.0000000000001647. -
Feasibility of Measuring Face-to-Face Interactions among ICU Healthcare Professionals Using Wearable Sociometric Badges.
Ito-Masui A, Kawamoto E, Nagai Y, Takagi Y, Ito M, Mizutani N, Yano K, Yano K, Imai H, Shimaoka M. Am J Respir Crit Care Med. 2020 Jan 15;201(2):245-247. doi: 10.1164/rccm.201904-0779LE. -
Talin-2 regulates integrin functions in exosomes.
Soe ZY, Prajuabjinda O, Myint PK, Gaowa A, Kawamoto E, Park EJ, Shimaoka M. Biochem Biophys Res Commun. 2019 May 7;512(3):429-434. doi: 10.1016/j.bbrc.2019.03.027. Epub 2019 Mar 14. -
Exosomal regulation of lymphocyte homing to the gut.
Park EJ, Prajuabjinda O, Soe ZY, Darkwah S, Appiah MG, Kawamoto E, Momose F, Shiku H, Shimaoka M. Blood Adv. 2019 Jan 8;3(1):1-11. doi: 10.1182/bloodadvances.2018024877. -
Systemic leukocyte-directed siRNA delivery revealing cyclin D1 as an anti-inflammatory target.
Peer D, Park EJ, Morishita Y, Carman CV, Shimaoka M. Science. 2008 Feb 1;319(5863):627-30. doi: 10.1126/science.1149859.