I. 良性骨腫瘍の治療
- 治療方針の決定
画像または生検により良性骨腫瘍および腫瘍類似疾患(以下良性骨病変)であることが確定したら次に治療法を慎重に検討する。良性骨病変は、必ずしも手術的治療が必要というわけではない。骨軟骨腫、内軟骨腫、線維性骨異形成、骨幹端部線維性骨皮質欠損、骨内脂肪腫のように偶然発見されるものが多いが、これらは無症状であれば経過観察のみで対応する。また好酸性肉芽腫は生検で診断さえつけば多くの病変は自然治癒する。しかし表1に示したような症例は積極的な手術治療を考慮することが望ましい。なお、病的骨折後に手術を行う際は、ギプス固定、シーネ固定など行い、仮骨が形成されてから手術を行った方が手技的に容易である。
表1 良性骨病変における手術の適応- 破壊的に進展する傾向の強い腫瘍
骨巨細胞腫、動脈瘤様骨嚢腫、軟骨芽細胞腫、類腱線維腫 など - 切迫骨折例または骨折例
線維性骨異形成、骨線維性異形成、内軟骨腫、単発性骨嚢腫など - 疼痛の原因となっている腫瘍
骨軟骨腫、類骨骨腫など - 関節機能に影響を与える可能性のある腫瘍
関節近傍に発生した骨軟骨腫など - 悪性化が危惧される腫瘍
一部の骨軟骨腫、内軟骨腫、線維性骨異形成など - 美容上問題のあるもの
骨軟骨腫など
- 破壊的に進展する傾向の強い腫瘍
- 良性骨病変に対する手術方法
A. 腫瘍掻爬術+骨または人工骨移植
充実性腫瘍や嚢腫の場合は腫瘍掻爬術後に骨または人工骨移植を行う。
1) 皮膚切開部位の決定:麻酔がかかったらイメージ下で腫瘍の部位を再度確認し、皮膚切開部位を確認する。皮膚切開は患肢の長軸方向に対して必ず縦切開とする。一般的には骨皮質のもっとも菲薄化した部分に最短でアプローチできる皮膚切開部位と進入路を選択する。しかし、術前の画像診断で悪性腫瘍の可能性がある場合は、術中迅速病理診断の結果で切開生検にとどめるか掻爬まで行うかを判断することになる。そのような場合には、後の広範切除の際の切除組織を最小限にとどめることを考えて、一つの筋肉内を縦切してアプローチする。
2) 骨皮質への開窓:骨皮質に達したら開窓をおこなう。長管骨への開窓は力学的な強度を保つためになるべく楕円形に開窓をおこなう。開窓の長軸方向の長さは骨腫瘍を完全に掻爬できるよう十分確保すべきであるが、開窓部の幅は術中術後の骨折の危険性を避けるために全周の1/3を超えないようにする。開窓方法は、細いサージアトームまたはK-ワイヤーで小孔を開窓の部の形に4-5mm間隔で作製し(図1―A)、その小孔を骨ノミまたはボーンソーにて慎重につなぐのがもっとも安全である(図1―B)。骨皮質が著しく菲薄化している場合には尖刃にても開窓が可能である。
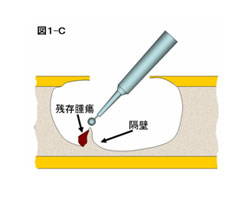
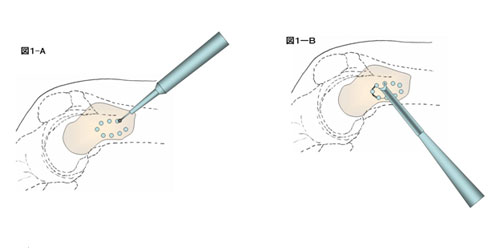 3) 掻爬:骨病変の再発を防ぐためには十分な掻爬が必要である。特に易再発性の骨巨細胞腫、軟骨芽細胞腫、骨線維性異形性、類腱線維腫などは徹底的な掻爬が必要である。掻爬の際はリュエル、髄核鉗子、鋭匙を使用する。特に鋭匙は様々な形と大きさのものを準備する。腫瘍壁に隔壁が存在している時は、十分な掻爬ができるようにサージアトームや鋭匙で隔壁を削り取る(図1―C)。開窓部近傍の骨皮質内側面も掻爬が不十分となりやすい部位であり注意を要する。正常骨組織が露出するまで掻爬を行うのが基本である。なお術前の検討で悪性腫瘍の可能性が少しでも疑われた場合は、術中迅速病理診断で良性腫瘍の診断を得てから掻爬を開始することが望ましい。単発性骨嚢腫の掻爬は、腫瘍壁に存在する膜様組織を確実に切除し、近位または遠位の嚢腫壁を破砕し正常骨髄と嚢腫を連絡させることが再発防止のためには重要と考えられている。
3) 掻爬:骨病変の再発を防ぐためには十分な掻爬が必要である。特に易再発性の骨巨細胞腫、軟骨芽細胞腫、骨線維性異形性、類腱線維腫などは徹底的な掻爬が必要である。掻爬の際はリュエル、髄核鉗子、鋭匙を使用する。特に鋭匙は様々な形と大きさのものを準備する。腫瘍壁に隔壁が存在している時は、十分な掻爬ができるようにサージアトームや鋭匙で隔壁を削り取る(図1―C)。開窓部近傍の骨皮質内側面も掻爬が不十分となりやすい部位であり注意を要する。正常骨組織が露出するまで掻爬を行うのが基本である。なお術前の検討で悪性腫瘍の可能性が少しでも疑われた場合は、術中迅速病理診断で良性腫瘍の診断を得てから掻爬を開始することが望ましい。単発性骨嚢腫の掻爬は、腫瘍壁に存在する膜様組織を確実に切除し、近位または遠位の嚢腫壁を破砕し正常骨髄と嚢腫を連絡させることが再発防止のためには重要と考えられている。
 4) 掻爬後の補助療法:掻爬後の腫瘍の残存をなるべく減らすために様々な補助療法が考案されている。レーザーによる腫瘍壁の焼灼、エタノールやフェノールによる化学処理、液体窒素による凍結・融解処理、浸透圧差による殺腫瘍を期待する蒸留水洗浄、などである。特に骨巨細胞腫は極めて再発率が高いためこれら補助療法を行うことが推奨されているが、その有効性を示すエビデンスはない。
4) 掻爬後の補助療法:掻爬後の腫瘍の残存をなるべく減らすために様々な補助療法が考案されている。レーザーによる腫瘍壁の焼灼、エタノールやフェノールによる化学処理、液体窒素による凍結・融解処理、浸透圧差による殺腫瘍を期待する蒸留水洗浄、などである。特に骨巨細胞腫は極めて再発率が高いためこれら補助療法を行うことが推奨されているが、その有効性を示すエビデンスはない。
5) 掻爬後の骨欠損部への骨または人工骨移植:好酸球性肉芽腫や手指の内軟骨腫は腫瘍掻爬のみで骨形成が促進されるので必ずしも骨移植、人工骨移植は必要ではないが、骨欠損部が大きい場合には骨または人工骨にて充填することが望ましい。以下に様々な骨充填材の特徴を示す。
- 自家骨:良好な骨形成が期待できるので現在までGolden standardとしてもっとも一般的に行われてきたが、採取できる自家骨の量には限りがある上に、採骨部の疼痛や神経障害などの合併症が少なくないことから、近年は人工骨へと主流が移りつつある。しかし、腫瘍の進展により軟骨下骨が欠損しているような症例では、軟骨下骨欠損部へは自家骨を充填することを勧める。
- 同種骨:欧米では一般的に行われているが、我が国ではその供給体制が十分機能しておらず、また病原伝播性の問題も完全には解決されていないことから一般化していない。
- PMMA骨セメント:十分な初期強度を得られることから早期社会復帰に有利と考えられている。また骨セメント硬化時に発生する重合熱による残存腫瘍の殺細胞効果を期待できる。骨との親和性は低い。
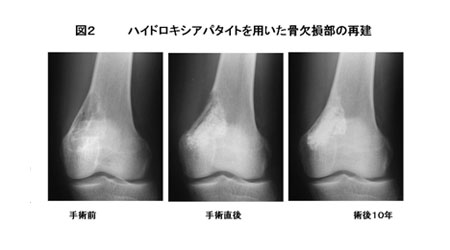
- ハイドロキシアパタイト(水酸アパタイト):我が国では1980年代なかばより厚生省より医療用具として認可され、自家骨移植あるいは同種保存骨移植にかわるものとして、整形外科領域に広く応用されている。ハイドロキシアパタイトは骨との親和性高く化学的に骨と結合する(図2)。海綿骨の微細形態を模倣し多数の気孔をもたせた多孔体と気孔をほとんど有さない緻密体があり、さらに粉末状、顆粒状、ブロック状のものが各社より販売されている。ハイドロキシアパタイトは一般的に気孔率が高くなるほど圧縮強度、曲げ強度は低下するが、骨芽細胞のScaffold(足場)としての機能は促進される。より高い骨伝導能を有した気孔間連通孔を有する製品も開発され良好な治療成績が報告されている。
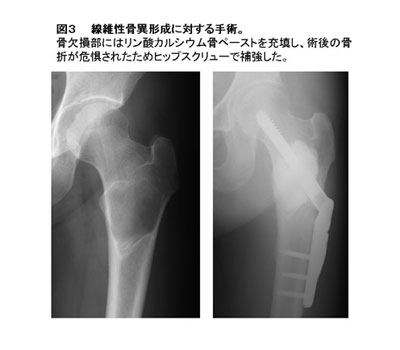
- リン酸カルシウム骨ペースト:粉剤と液剤の配合比の調節によりペースト状あるいは粘土状で使用することができるために、簡便で操作性が良い。ペースト状で充填する場合は添付のシリンジを用いて充填する。硬化後、生体内で水和反応によりハイドロキシアパタイトに変化する。圧縮強度、生体親和性は高いが材料内への骨侵入はなく緻密体ハイドロキシアパタイトと同じ状態と考えられる。
- リン酸三カルシウム(β-TCP):圧縮強度が極めて低く操作性も悪いが、ハイドロキシアパタイトに比べ生体内で分解、吸収を受けやすく、再生骨に置換されると期待されている。
- ハイドロキシアパタイト/リン酸三カルシウム混合体:ハイドロキシアパタイトとリン酸三カルシウムの吸収性を併せ持つことを目的として開発された。生体内では一部が吸収され骨に置換される。
 7) 閉創:自家骨あるいは人工骨充填後は保存してあった開窓部の骨皮質片をもとにもどし骨膜などで逢着する。なお開窓部の骨皮質片を戻して蓋をするときには内面に付着している腫瘍を十分に掻爬しておくことを忘れてはならない。創部を十分洗浄し,ドレーンを留置した後閉創する。
7) 閉創:自家骨あるいは人工骨充填後は保存してあった開窓部の骨皮質片をもとにもどし骨膜などで逢着する。なお開窓部の骨皮質片を戻して蓋をするときには内面に付着している腫瘍を十分に掻爬しておくことを忘れてはならない。創部を十分洗浄し,ドレーンを留置した後閉創する。
B. 腫瘍切除術
隆起性の病変である骨軟骨腫は無症状であれば手術治療は必要ない。しかし、急速な増大傾向を示す症例や疼痛を有する症例は切除術の適応となる。切除は骨軟骨腫の基部から骨ノミで切除するようにする。再発を防ぐためには軟骨帽を完全に切除することが重要である。小児の場合は成長軟骨を損傷しないように気をつける(図4)。また腓骨近位端の骨巨細胞腫や肋骨の線維性骨異形成のように再建を必要としない腫瘍の場合は切除術のみ行う。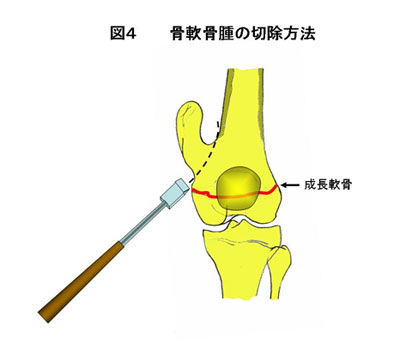 c. 類骨骨腫の腫瘍掻爬術
c. 類骨骨腫の腫瘍掻爬術
類骨骨腫はnidus(ナイダス)といわれる骨内の小病変が疼痛の原因となっている。イメージを用いて病変部直上の骨皮質にK―ワイヤーでマーキングした後、病変に向けてサージアトームで骨皮質を慎重に削る。病変部に到達したら小鋭匙にて病変部を徹底掻爬する。現在、三重大学では低侵襲治療を目標にしており。IVR科とタイアップしてTガイド下のラジオ波焼灼術または凍結療法を行い、良好な治療成績を挙げている。
d. 単発性骨嚢腫における様々な治療
単発性骨嚢腫に対する治療は、掻爬術と自家骨移植が従来行われてきたが、近年は人工骨の発達とともにハイドロキシアパタイトなどを充填することが多くなっている。しかし、その再発率が30%―50%と高いために、様々な手術術式が考案されている。
1) 嚢腫減圧術
単発性骨嚢腫の内圧を減圧するとその治癒が促進されることに着眼した手術方法である。嚢腫壁を掻爬した後さらに嚢腫壁をK―ワイヤーでドリリングする(multiple drill-hole法)。近年、multiple drill-hole法施行後にチタン製cannulated screwもしくはハイドロキシアパタイト製中空ピンを嚢腫内と骨外を連絡させるように留置すると、ドレナージ効果が高まり嚢腫の治癒が促進されるとの報告もある。
2) ステロイド注入法
イメージ下で嚢腫内に金属針を挿入し内容物を吸引し診断を確定し、造影剤を注入し嚢腫壁を確認後、メチルプレドニゾロン(Depo-medrolR)を嚢腫内に注入する。低侵襲ではあるが、再発率が高いために何度も手技を繰り返す必要のある症例が少なくない。
e. 人工関節置換術
骨巨細胞腫のように局所で骨破壊的な進展を示す腫瘍の中には、掻爬+骨移植(または代替骨移植)では対応できないほどの高度な骨破壊や、関節機能障害を生じている症例がまれに存在する。そのような症例は腫瘍用人工関節が適応となる。悪性腫瘍の場合と異なり、良性骨腫瘍に行う人工関節は筋肉、靱帯の切除が少なくてすむために術後患肢機能は良好であるが、術後合併症(人工関節のゆるみ、破損、感染など)のリスクは大きい。 - 後療法
腫瘍掻爬+骨または代替骨移植の場合は、病変部の部位、骨皮質の状態、開窓部の大きさ、使用した骨充填材にもよるが、翌日から関節可動域訓練を開始するようにする。荷重肢に充填した場合は、内固定を併用している症例では術後3週間で全荷重を許可するが、内固定を併用していない症例には全荷重まで6週間以上の期間を設ける方が安全である。骨軟骨腫の切除などは通常1週間以内に全荷重を許可しても支障はない。
II. 悪性骨腫瘍の標準的治療
- 原発性骨腫瘍の疫学と分類
WHOによる骨腫瘍分類を表2にしめす。
骨腫瘍の原発性骨悪性腫瘍は非常に稀な疾患である。そのなかでも骨肉腫の頻度がいちばん高いがそれでも、我が国の粗罹患率は人口10万人に対して男0.7、女0.5程度である。次に軟骨肉腫、ユーイング肉腫と続く。好発年齢は、骨肉腫およびユーイング肉腫は10代の学童期、青少年期であるが、軟骨肉腫は30歳以降の成人に発症する。
原発性悪性骨腫瘍の治療成績は1980年頃より導入された化学療法の進歩により飛躍的に向上してきた。骨肉腫の場合、1980年以前の5年生存率は10%程度という悲惨な状況であったが、近年抗癌剤の多剤併用療法が行われるようになり5年生存率は70%程度にまで改善してきた。治療開始時遠隔転移のない軟骨肉腫の5年生存率は70%である。しかしユーイング肉腫は依然として予後は悪く50%程度である。
現在、骨肉腫、ユーイング肉腫に対する抗癌剤治療の有効性は確立されており、術前化学療法→手術(腫瘍切除)→術後化学療法の治療プロトコールに沿って治療することが標準的治療とされている。
- 骨悪性腫瘍に対する化学療法
骨肉腫、ユーイング肉腫に対しては化学療法を行うのが原則である。但し患者がの高齢者や、腎障害、肝機能障害、などの合併症を有する場合は、抗癌剤の量を減らすことが多い。時に、抗ガン治療を断念せざるを得ない事もある。
骨肉腫に有効な抗癌剤はアドリアマイシン、シスプラチン、イフォスファミド、メソトレキサートなどであり,これらを組み合わせた様々な投与スケジュールが考えられている(図5)。ユーイング肉腫の場合は上記の抗癌剤のほかに、ビンクリスチン、シクロホスファミド、アクチノマイシンD、エトポシドなどが使用される(図6)。軟骨肉腫には抗癌剤は有効性に乏しいと考えられている。 - 骨悪性腫瘍に対する手術療法
化学療法に感受性の高い骨肉腫やユーイング肉腫の場合は、術前化学療法を終了した後に、病巣を外科的に切除する。抗癌剤抵抗性の軟骨肉腫などは、化学療法は行わずに、診断確定後に速やかに手術計画を立てるのが一般的である。
四肢に発生した原発性悪性骨腫瘍の治療は、1980年以前は切断術を行うのが一般的であったが、抗癌剤療法の発達、画像診断技術の進歩、手術手技の進歩、腫瘍用人工関節の発達により、今日では、患肢温存術が標準的治療法となっている。
原発性骨悪性腫瘍の場合は、腫瘍の取り残しの無いよう、腫瘍から充分な切除縁を確保した腫瘍広範切除術を原則とする。広範切除術の概念を図7に示す。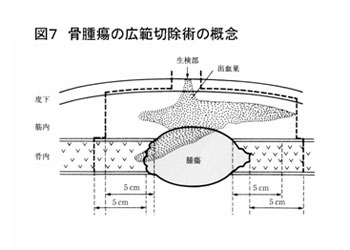 広範切除後の骨欠損部の再建は、腫瘍用人工関節置換術あるいは生物学的患肢再建法を行う。
広範切除後の骨欠損部の再建は、腫瘍用人工関節置換術あるいは生物学的患肢再建法を行う。
A. 腫瘍用人工関節による再建
腫瘍用人工関節は我が国では現在のところ、上腕骨近位、上腕骨遠位、大腿骨近位、大腿骨遠位、脛骨近位に対するものが使用可能となっている。下肢に使用した場合は、手術後早期に荷重歩行練習が可能であり、優れた患肢機能を得ることが出来る。しかしその反面、手術後の感染、人工関節のゆるみ、人工関節の破損、などの問題が完全に克服されたとは言えず、課題を残している。また、患者がスポーツ選手の場合は、義肢装具の著しい進歩に伴い、高い運動能力を維持できることから、むしろ切断術を選択する場合もある。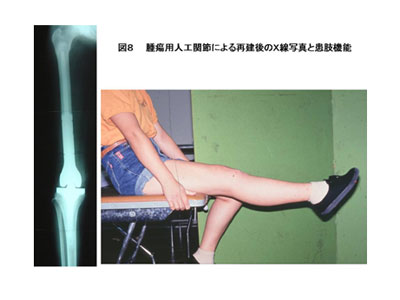 B. 生物学的患肢再建法
B. 生物学的患肢再建法
腫瘍切除後に生じた骨欠損部位に生体由来の組織を移植することにより再建する方法である。我が国では特にこの方面の再建方法の研究が進んでいる。いずれの方法もうまくいった場合は良好な患肢機能が得られるが、合併症が多く、機能獲得までに数回の手術を要することがあるのが欠点であり、その適応は限られているのが現状である。- 自家骨移植:欠損部が大きい場合は血管柄付き自家骨移植が必要となる。Donor siteに骨欠損が生じること、技術的な困難さ、治療期間が長いことなどが問題である
- 同種骨移植:欧米ではかなり一般化しているが、移植骨が吸収されることも多く、長期成績は安定していない。我が国では供給体制の問題もあり、普及していない。
- 温熱処理骨:切除した腫瘍を含む骨組織を、加温処理した後、元の部位に再移植する方法。70℃、30分処理するパスツール処理とオートクレーブ処理するオートクレーブ処理骨が存在するがオートクレーブ処理骨は骨の強度、骨再生能に問題があり、最近は行われていない。
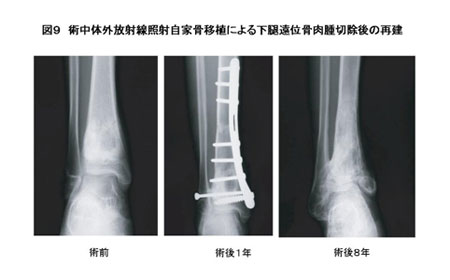
- 放射線処理骨(術中体内照射、体外照射):手術中に腫瘍を切除することなく手術室で病変部に高容量の放射線照射を行う術中体内照射と、切除病変に放射線照射を行った後、再度体内に戻す術中放射線体外照射自家骨移植術がある。我々は術中放射線体外照射自家骨移植術により良好な成績を得ている(図9)。
- 凍結処理骨(液体窒素):液体窒素で切除腫瘍を凍結させた後、切除部位に戻す手技
- 骨延長、骨移動、脚延長:創外固定を用いて骨延長または骨移動を行い骨欠損部に新生骨を形成させる。
- 骨悪性腫瘍に対する放射線治療
原発性骨悪性腫瘍ではユーイング肉腫が放射線に対する感受性が強く、効果が高いことが知られている。骨盤、脊椎など手術が困難な部位に腫瘍が発生した場合は放射線治療の適応となる。骨肉腫では可能な限り手術的に切除することが推奨されているが、再発例には放射線治療を行う場合がある。一般的に軟骨肉腫に対して放射線治療は無効である。 - 悪性骨腫瘍に対する粒子線治療
最近、脊椎や骨盤に発生する脊索腫や骨肉腫、軟骨肉腫、ユーイング肉腫に対する粒子線治療の有効性が明らかとなってきている。特に脊索腫に対する重粒子線治療はQOLを保ちながら手術に匹敵する治療効果が期待できるため、手術にかわる治療法として世界中から注目されている。我が国での重粒子線治療の先駆的施設は千葉の放射線医学総合研究所の重粒子医科学センター病院であるが、三重大学整形外科は設立当初から、骨軟部腫瘍の重粒子線治療の臨床応用に深く係わっている。
III.転移性骨腫瘍に対する治療
近年、悪性腫瘍に対する治療の進歩は著しく、担癌患者の生命予後は改善してきたが、転移性骨腫瘍の頻度は増加傾向にあり、一般整形外科医であっても日常診療でしばしば遭遇する。特に乳癌、前立腺癌、肺癌は我が国においてその発生数は増加傾向にある上に骨転移を来しやすい腫瘍でもあり、適切に治療することが重要である。
- 転移性脊椎腫瘍に対する治療
無症状である場合はビスフォスフォネート製剤であるゾレドロン酸(商品名ゾメタ)または、RANKLに対する完全ヒト型モノクローナル抗体であるデノスマブ(諸品名ランマーク)を投与する。近年各種癌の抗癌剤治療の進歩により、骨病変の進行が抗癌剤により抑制されることも多い。しかし背部痛、腰痛などの疼痛が存在する場合にはMRIで精査の上、早急に放射線治療を併用することが望ましい。
また、下肢の脱力など脊髄圧迫による麻痺症状が存在するようであれば、患者の全身状態などを考慮した上に椎弓切除術などの手術的治療を行う。
- 下肢長管骨の骨転移に対する治療
転移性骨腫瘍の中でも、下肢長管骨転移は、著しいQOL低下の原因となるため、適切な治療を行うことが重要である。転移性骨腫瘍の切迫骨折、病的骨折に対する手術は、厳密な意味での緊急性はないが、患者のQOLのことを考えると、なるべく早く(準緊急的に)手術を行うのが望ましい。
A.下肢長管骨転移性骨腫瘍に対する治療原則
転移性骨腫瘍の手術は疼痛をコントロールし、運動機能を回復させQOL低下を防ぐことにある。従って”cure” よりも”care”を目指す緩和療法的な意味合いが強い。しかし下肢の長管骨の場合、いずれ骨折を来す可能性が高いので、発見したら積極的に外科的治療を考えるのが正しい。適切に骨転移をmanagementするためには、以下のような原則で治療を行うべきだと考えている。1) なるべく早く治療にとりかかる。2) 可能な限り外科的に治療する。3) 患者の状態は次第に悪化していくことが予想されるので、再発による再手術する必要のないよう手術術式は必要かつ十分な方法を選択する。4) 外固定が必要となるような術式は選択しない。5) 必要であれば術後に放射線治療を追加する6) 入院期間の短縮をめざす
B.下肢長管骨転移性骨腫瘍に対する手術療法
手術手技の選択は意見の分かれるところであるが、われわれは、図10のように、術式選択を行っている。術後は、いずれの術式でも、ドレーンを抜去したら一週間以内に歩行練習を開始し、なるべく早期に元の生活に戻るようにしている。病巣が残存する術式を選択した場合は、症例に応じて術後20~40 Gyの放射線照射を行う。脊椎転移など合併している場合にはその部位の放射線治療を同時におこなう。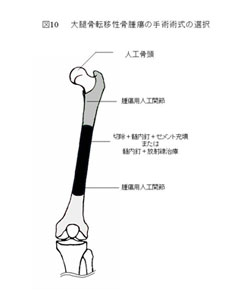
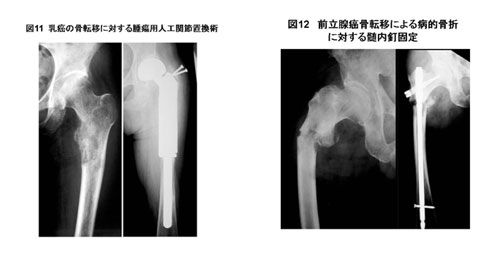
- 原発不明の場合の原発巣検索について
来院時原発不明の場合、転移性骨腫瘍の原発巣の診断は、腫瘍マーカーの数値、胸部および腹部CTスキャン、内視鏡を用いた上部および下部消化管検索などを行うが、骨折をしている場合には、画像検査は患者に多大な苦痛を強いることになるので、侵襲的な検査は術後にすることが望ましい。切迫骨折の時でも全身検索をあまりにも長期間にわたって進めると、全身状態の悪化を招くと共に、検索中に骨折を来してしまうことがあるので、なるべく短期間に検査を済ませるようにする。







